Rutherford Atom Modeli Maketi
kaynağı değiştir]
kaynağı değiştir]
DALTON ATOM TEORİSİ
Kimyasal birleşmenin yukarıdaki iki yasasından yararlanan John Dalton 1803 - 1808 tarihleri arasında bir atom kuramı geliştirdi.Dalton Kütlenin Korunumu Yasası ve Sabit Oranlar Yasasından yola çıkarak maddeyi oluşturan ve onun bütün özelliklerini gösteren çok küçük parçacıkların olduğu yorumunu yaparakKatlı Oranlar Kanunu’nu ortaya atmıştır:
Katlı Oranlar Kanunu, iki element birden fazla bileşik oluşturuyorsa, birinin belli bir miktarına karşılık, diğerinin değişken miktarları arasında küçük ve tam sayılarla ifade edilen bir oran vardır, şeklinde tanımlanabilir.
Katlı Oranlar Kanunu, kimyasal elementlerin atom adı verilen parçalanamaz parçacıklardan oluştuğunu ve her elementin atomlarının kütlesinin aynı olduğunu gösterir.
Dalton’a göre:
1. Bir elementin bütün atomları şekil, büyüklük ve kütle yönüyle aynıdır.
2. Atomlar içi dolu küreciklerdir.
3. Bilinen en küçük parçacık atomdur.
4. Atomlar parçalanamaz, yeniden oluşturulamaz.
5. Atomlar belirli oranlarda birleşerek molekülleri meydana getirir. Elementin bütün atomları aynı olduğu gibi bir bileşiğin de bütün atomları aynıdır.
Dalton teorisinde pek çok yanlışlık ve eksiklik olmasına rağmen çok önemlidir.Kendisinden sonra gelen bilim adamlarına bir kapı aralamış, fikir ortaya atarak tartışılmasını sağlamıştır. Böylece daha doğruya ulaşma imkanı sağlamıştır.
Dalton Atom Teorisindeki Eksiklik ve Hatalar :
1. Bir elementin bütün atomları aynı değildir. O dönemde nötron tanecikleri tespit edilemediği için izotop atomların farkına varılamadı. Bir elemente ait bütün atomların proton ve elektron sayısı aynı olmak zorundadır. Nötron sayısı farklı olsa da aynı elemente aittir, fakat farklı atomdur.
2. Atomların içi dolu değildir. Aksine boşluklu yapıya sahiptir.
3. Bilinen en küçük parçacık atom değildir. Günümüzde atom çekirdeğini oluşturan 70 çeşit parçacığın var olduğu ve bunların bilinen 50 hareketinin olduğu ifade edilmektedir.
4. Bir elementin bütün atomları aynı olmadığı gibi bir bileşiğin bütün molekülleri de aynı değildir.
THOMSON ATOM MODELİ
Havası alınmış tüplerin iki ucuna yerleştirilen elektrotlara (katot ve anot) yüksek gerilim uygulandığında katottan anoda doğru ışınların yayıldığını ve bu ışınların manyetik alanda da pozitif kutbun etkisiyle sapmaya uğradığını tespit etmiştir. Katot ışınları adı verilen bu ışınlar negatif elektrikle yüklüydü. Thomson, bu ışınların sapmalarından yararlanarak yük/kütle oranlarını hesapladı. Bu oran, iyonların ölçülen yük/kütle oranlarına göre çok büyüktü. Bu sonuca göre katot ışını birimleri negatif yüklü, çok küçük kütleli atom içi parçacıklardı. Atomda negatif (-) yüklü parçacıklar olduğuna göre pozitif (+) yüklü parçacıklarda, yani protonlarda olmalıydı.
Bu tespitlerden sonra Thomson atomda (+) ve (-) yüklü parçacıkların var olduğunu ve bunların atomda rasgele dağıldığını ifade etmiştir.Rasgele dağılmayı da üzümlü kek örneğiyle izah etmiştir.
| Thomson atom teorisine göre: 1.Atom protonlardan oluşmuş küre şeklindedir.Protonlar (+1) birim yüke,elektronlar ise (-1) birim yüke sahiptir. 2.Elektronlar atomun içinde homojen olarak dağılmıştır. 3.Nötr atomda proton sayısı kadar elektron bulunmaktadır. 4. Elektronların kütlesi protonların kütlesinden çok küçüktür. Bu nedenle ihmal edilebilir. 5. Protonlar ve elektronlar atomda rasgele dağılmıştır. |
RUTHERFORD ATOM TEORİSİ

Rutherford çok ince (10-6 cm) altın levhaya alfa (α) tanecikleri (Helyum çekirdeği) göndermiştir. Bu taneciklerin çok az bir kısmı aynen yansırken bazıları belli açılarla yansımış fakat büyük bir bölümü aynen geçmiştir.
Yapılan deney sonucuna göre :
1. Atomdaki pozitif(+) yükler çekirdek denen çok küçük bir bölgededir.
2. Alfa (α) taneciklerinin sapmasına yol açan yoğun kesim çekirdekte toplanmıştır.
3. Çekirdekteki yük miktarı, bir elementin bütün atomları için aynı, farklı atomları için farklıdır.
4. Elektronlar çekirdekten oldukça uzakta yer alırlar. Elektronların bulunduğu hacim, çekirdeğin bulunduğu hacimden çok büyüktür. Atomun büyük bir kısmı boşluklu yapıya sahiptir.
BOHR ATOM MODELİ
| Bohr yaptığı çalışmalarda Rutherford atom modeline göre,elektronların çekirdek etrafında dönmeleri ile enerji yaymaları sonucunda enerjilerinin azalacağını ve çekirdek üzerine düşeceklerini hesapladı, fakat böyle bir elektron düşmesi gerçekleşmediği için Rutherford atom teorisinin bazı yanlışlıklarının olması gerektiğini fark etti ve bu teoriye bazı eklemeler yaptığı yeni bir atom modeli ortaya attı.Rutherford, elektronların çekirdekten oldukça uzakta yer aldığını ifade etmişti. Bohr da elektronların ne kadar uzakta yer aldıklarını, çekirdek etrafındaki hareketlerini ve enerjilerini incelemiştir.Araştırmaları 1H, 2He ve 3Li+ gibi küçük atom ve iyonlar üzerinde olmuştur.Elde ettiği sonuçlar küçük atomlar için doğru iken büyük atomlar için hatalı olmuştur.
|
Bohr Atom Teorisine Göre:
1. Elektronlar çekirdek çevresinde rasgele dairesel bir yörüngede değil, çekirdekten oldukça uzakta sabit bir enerjiye sahip dairesel yörüngelerde hareket ederler.
2. Elektronlar çekirdek etrafında sabit enerjili dairesel yörüngelerde (orbitallerde) hareket ederler. Buyörüngelere Enerji Seviyesi adı verilir.
3. Bohr atom kuramına göre, hidrojen atomunun 1 elektronu en düşük enerji düzeyi olan n=1 de bulunur. Buna Temel hâl denir. Elektron temel hâlden uzaklaştırılırken n=2, n=3, n=4 hâllerinden birine getirilirse uyarılmış olur. Uyarılmış hâlde elektronun enerjisi daha fazla olur.Daha az enerjili (uyarılmış) duruma göre kararsızdır. Elektrona verilen enerji kaldırıldığında düşük enerjili uyarılmamış (kararlı duruma) hâle geçer. Bu sırada iki enerji seviyesi farkı kadar ışın yayınlar. Elektronlar yüksek enerji düzeyinden düşük enerji düzeyine geçerken enerji yayarlar. Düşük enerji düzeyinden yüksek enerji düzeyine geçerken de enerji alırlar.
NOT: Bir atomun elektronları dışardan enerji alarak yüksek enerji düzeyine yükselirse bu atoma "uyarılmış atom" denir. Bu olaya uyarılma denir. Uyarılmış atom yüksek enerji düzeyinden düşük enerji düzeyine geçtiğinde iki enerji düzeyi arasındaki enerji farkına eşit bir ışık (foton) yayınlar.Bu yayınlanan ışınlar her element için karakteristik özellik gösterir.Yayınlanan ışının şiddetine göre cisimlerin bazılarını mikroskop bazılarını ise gözümüzle gözlemleyebiliriz.

Gözümüz yayınlanan bu ışınların sadece dalga boyu(λ ) 7.10−5 cm olan kırmızı ışık ile 4,5.10−5 cm olan mor ışık arasındaki kısmı görür.Daha kısa dalga boylu ışımaları duyu organlarımızla algılayamayız.
4. Çekirdekten uzaklaştıkça elektronun enerjisi de artar. Elektronlar, bulundukları enerji seviyesinin enerjisine sahiptir. Enerji seviyeleri atom çekirdeğine yakınlığına göre n = 1, 2, 3, 4, 5, 6 gibi tamsayılarla veya K, L, M, N, O, P, Q gibi harflerle ifade edilirler.
Yörünge sayısı (n) olmak üzere yörüngenin sahip olduğu enerji; -18
En = -2,18.10 J bağıntısı ile bulunur.
n2
Bu konuya bakanlar bunlara da baktı
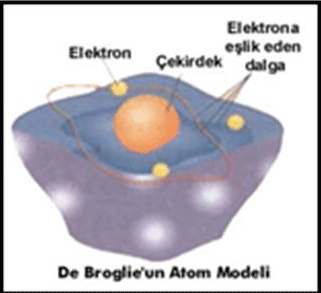
 ATOM MODELLERİ Atomun yapısının aydınlatılması elektriksel deneylerle mümkün olmuştur. Bu deneylerin sonuçları bilim insanlarının ilgisini çekmiştir. 19. yüzyılın başlarında atomun yapısının anlaşılması için yapılan çalışmalar hızlanmış, bunun sonucu olarak günümüze kadar birçok teori, model ve kanun ortaya atılmıştır. Bilimdeki hızlı teknolojik gelişmelerle atomların yapısı tam olarak açıklanmış, atomların özelliklerinin değişimini periyodik olarak gösteren modern periyodik cetvel hazırlanmıştır. Daha da önemlisi periyodik cetvelde her element için bir kutucuk ayrılmış, bu kutucukta elementlerin fiziksel ve kimyasal özelliğini göstermeye yarayan sayılara yer verilmiştir. ATOM MODELLERİ MÖ 5. yüzyılda Yunan filozofu Demokritos, bütün maddelerin bölünemez anlamına gelen atomos olarak adlandırılan çok küçük, bölünmez taneciklerden oluştuğunu öne sürmüştür. Demokritos’un bu fikri, özellikle Platon ve Aristo gibi pek çok çağdaşı tarafından kabul edilmemekle birlikte, bu fikir uzun süre varlığını sürdürmüştür. İlk bilimsel araştırmalardan elde edilen deneysel kanıtlar “atom” kavramına destek sağlamış ve zamanla element ve bileşiklerin modern tanımlarının yapılmasını sağlamıştır. Bugün atom adını verdiğimiz maddenin bölünmez yapı taşlarının tanımı, 1808 yılında İngiliz öğretmen ve bilim insanı John Dalton tarafından ilk olarak yapılmıştır. Dalton Atom Modeli (1803) Dalton’un çalışmaları kimyada modern çağın başlangıcıdır. Dalton atom modeline göre: Elementler atom adı verilen son derece küçük ve bölünemeyen taneciklerden oluşur. Belli bir elementin bütün atomları birbirinin aynıdır; yani bu atomların boyutları eşittir, hepsi aynı kütleye sahiptir ve kimyasal özellikleri aynıdır. Ancak bir elementin atomları diğer elementlerin atomlarından farklıdır. Bileşikler birden çok elementin atomlarından oluşmuştur. Herhangi bir bileşikteki iki elementin atom sayılarının oranı bir tam sayı ya da basit tam sayılı bir kesirdir. Kimyasal tepkimeler yalnızca atomların birbirinden ayrılması, birbiri ile birleşmesi ya da yeniden düzenlenmesinden ibarettir; bu tepkimeler atomların yok olmasına ya da oluşmasına yol açmaz. Dalton atom modeli kimyanın üç temel yasası; sabit oranlar, kütlenin korunumu ve katlı oranlar yasasını destekleyerek açıklar. Thomson Atom Modeli (1902) 1900’lü yılların başında, atomların iki özelliği açıkça belli olmuştu: Atomlar elektronlar içeriyordu ve elektriksel olarak nötrdü, yani yüksüzdü. Elektriksel açıdan yüksüz olabilmesi için bir atomda eşit sayıda artı ve eksi yük bulunmalıydı. Joseph John Thomson 1897’de katot ışınları ile yaptığı deneyler sonucunda bazı ipuçlarına ulaşmış ve Dalton modelinin eksiklerini tamamlamıştır. Bu bilgilere dayanarak J. J. Thomson; atomu, içinde gömülmüş hâlde elektronlar bulunan artı yüklü bir küre olarak öneriyordu. Thomson’un bu “üzümlü kek” benzeri atom modeli uzun yıllar atom kuramı olarak kabul gördü. Thomson atom modeline göre: Atomlar, yaklaşık çapı 10−10 m olan içi dolu, nötr kürelerdir. Küre içerisinde artı yüklü protonlar ve eksi yüklü elektronlar homojen dağılmıştır. Thomson kürenin dış yüzeyini pozitif yüklü taneciklerin oluşturduğunu kürenin içini de elektronların işgal ettiğini söylemiştir (üzümlü kek modeli). Atomlarda pozitif yüklere eşit sayıda negatif yük bulunur. Bundan dolayı atomlar yüksüzdür. Elektronların kütlesi atomun kütlesi yanında ihmal edilecek kadar küçüktür. Atomun kütlesinin büyük bir kısmını pozitif yükler oluşturur. Thomson’un yapmış olduğu çalışmalar sonucunda atomda artı yükler kadar eksi yüklerin olduğu ve atomda bu yüklerin homojen dağıldığı fikri ortaya çıkmıştır. Öğrencisi Ernest Rutherford yaptığı deneylerle bu dağılımın böyle olmadığını göstermiştir. Rutherford Atom Modeli (1911) 1910’da Ernest Rutherford, alfa taneciklerini kullanarak atomun yapısını inceledi. Radyoaktif bir kaynaktan çıkan alfa taneciklerinin çok ince altın ve başka metal yapraklardan saçılmasını gözlemledi. Deneylerinde alfa taneciklerinin çoğunun metal yaprakların içinden sapmadan ya da çok az sapma yaparak geçtiğini gördü ancak zaman zaman bazı alfa taneciklerinin büyük bir açı ile sapma yaptığını da fark etti. Bu ışınları flüoresan boya (ZnS: çinko sülfür) sürülmüş ekran üzerinde ışık parıldamalarıyla gözlemledi. Bu ışınların çoğunun levhayı geçtiğini pek azının büyük açılarla saptığını pek azının da kaynağa geri döndüğünü gördü. Bu deneyin sonuçlarını açıklayabilmek amacıyla, Rutherford atomun yapısı için yeni bir model oluşturdu. Rutherford atom modeline göre: Bir atomun kütlesinin çok büyük bir kısmı ve pozitif yükün tümü, çekirdek denen çok küçük bir bölgede yoğunlaşır. Atomun büyük bir kısmı boş bir uzay parçasıdır. Pozitif yükün büyüklüğü atomdan atoma değişir ve elementin atom kütlesinin yaklaşık yarısıdır. Çekirdeğin dışında, çekirdek yüküne eşit sayıda elektron bulunur. Atomun kendisi elektrik yükü bakımından nötrdür. E. Rutherford geliştirdiği atom modeliyle Thomson’un proton ve elektronun homojen dağılma ilkesini çürütmüştür. Bununla birlikte Rutherford atom modeli önemli bir sorunu çözümsüz bırakmıştır. Rutherford’un zamanında, en basit atom olan hidrojenin bir tane proton; helyum atomunun ise iki proton içerdiği biliniyordu. Bu nedenle helyum atomunun kütlesinin hidrojen atomunun kütlesine oranı 2/1 olmalıydı (Elektronlar protonlardan çok daha hafif olduğundan elektron kütleleri ihmal edilebilir). Oysa gerçekte bu oran 4/1 idi. Rutherford ve diğer araştırmacılar, atom çekirdeğinde diğer bir atom altı taneciğin bulunması gerektiğini düşündüler. Rutherford bu taneciklerin yüksüz olması gerektiğini tahmin etti. Bunun kanıtı 1932’de İngiliz fizikçi James Chadwick tarafından keşfedildi. Chadwick ince bir berilyum levhayı alfa (α) tanecikleriyle bombardıman ettiğinde, berilyum metalinin gama ışınlarına benzeyen çok yüksek enerjili ışınlar yaydığını görmüştür. Daha sonraki deneyler ile bu ışınların protonun kütlesinden biraz daha büyük kütleye sahip elektrik yükü taşımayan nötr taneciklerden oluştuğu gösterildi. Chadwick bu taneciklere nötron adını verdi. Rutherford atom modeli alfa tanecikleri saçılma deneyinin sonuçlarıdır. Fakat atomlardaki elektronların hareketini ve atomların yaydığı ışınların spektrumlarını açıklamada yetersiz kalmıştır. Atomların Absorpsiyon/Emisyon Spektrumu Bohr Atom modelinin anlaşılması için maddelerin ışık ile etkileşimleri sonucu oluşan absorpsiyon ve emisyon spektrumlarının bilinmesi gerekir. Maddeyi oluşturan tanecikler hakkındaki önemli bilgiler, ışığın madde ile etkileşmesinin incelenmesinden edinilmiştir. Bu bakımdan ışık hakkındaki bilgilerin anımsanmasında yarar vardır. Işığın yapısı hakkında elektromanyetik dalga ve foton olmak üzere geçerli iki model vardır. Dalga Terimleri: Dalga boyu (λ, lamda) Dalga üzerinde art arda gelen iki tepe veya iki çukur nokta arasındaki uzaklıktır. Birimi metre (m) veya nanometre (nm) vb. Genlik (A) Bir dalganın maksimum yüksekliği veya minimum derinliğidir. Dalganın şiddeti genliğin karesiyle doğru orantılıdır. Frekans (ν, nü) Belli bir noktadan bir saniyede geçen dalga sayısıdır. Birimi Hertz’dir (1/s). Işığın frekansı ışık kaynağına bağlı olup ortamına bağlı değildir. Işık Hızı (c) Boşlukta (vakumda) bütün elektromanyetik dalgalar, dalga boyuna bakılmaksızın aynı hızla hareket ederler. Işık hızı “c” sembolü ile gösterilen ve 3.108 m/s değerinde olan hıza denir. Belli bir ışıma için dalga boyu ile frekansın çarpımı elektromanyetik dalgaların ışık hızına eşittir. c = λ.ν Mor ötesi (UV), görünür bölge ışınları, kızıl ötesi ışınlar (IR), Radyo ve TV dalgaları bilinen elektromanyetik ışıma türleridir. Elektromanyetik ışınlar uzayda dalga hareketi ile ilerler. Bütün ışınların frekanslarını ya da dalga boylarını gösteren elektromanyetik ışın dizisine elektromanyetik dalga spektrumu denir. Elektromanyetik dalga spektrumunda radyo dalgaları, çok uzun dalga boylarına; kızıl ötesi ışınlar, orta uzunlukta dalga boylarına sahiptirler. Radyoaktif tepkimeler sonucu oluşan gama ışınları, çok kısa dalga boylarına sahiptir. Görünür bölge ışınları yaklaşık 380 nm - 760 nm dalga boyları arasındaki ışınları içerir. Görünür bölgeden daha küçük dalga boylu, yüksek frekanslı ışınlara mor ötesi ışınlar (UV) denir. Görünür bölgede daha büyük dalga boylu ve küçük frekanslı ışınlara kızıl ötesi (infrared) ışınlar denir. Değişik bölgelerdeki elektromanyetik ışınlar, madde ile değişik şekillerde etkileşir ve maddenin tanınmasında bu etkileşimlerden yararlanılır. Madde ile elektromanyetik ışınımın etkileşimini inceleyen bilim dalına spektroskopi denir. Spektroskopi, çoğunlukla kullanılan elektromanyetik ışınımın bulunduğu bölgeye göre isim alır. Örneğin mor ötesi ışınlar ultraviyole (UV) olarak adlandırılır. Bir dalga boyundan diğerine geçişin sürekli olduğu spektrumlara sürekli spektrum denir. Örneğin beyaz ışık (Güneş ışığı), bir prizmadan geçirilip dalga boylarına ayrılırsa sürekli bir spektrum elde edilir. Renkler yani dalga boyları arasında kesintisiz bir geçiş vardır. Beyaz ışığın spektrumunda gökkuşağında olduğu gibi iç içe girmiş kırmızı-turuncu-sarı-yeşil-mavi-mor renkler bulunur. Görünür bölge ışınlarından en çok kırılan mor rengin dalga boyu en küçük, en az kırılan kırmızı rengin dalga boyu en büyüktür. Beyaz Işığın Prizmadan Geçişi: Sürekli spektrum verebilecek beyaz ışık bir gazdan, örneğin hidrojenden geçirildikten sonra prizmada kırılırsa elde edilen spektrumun belirli frekanslarında siyah çizgiler görülür. Bu spektrumlara absorbsiyon (soğurma) spektrumu denir. Bu çizgilerin yeri ve sayısı, ışığın içinden geçtiği maddenin cinsine bağlıdır ve maddenin tanınmasını sağlar. Spektrumun bu şekilde kullanılması, insanların birbirinden ayırt edilmesine yardımcı olan parmak izlerine benzer. Gaz hâlindeki bir elemente gerilim uygulandığında o element ışık yayar. Yayınlanan ışık prizmadan geçirilirse farklı renklere ayrılır. Bu renkler çizgi şeklinde oluşur. Bu spektrumlara yayınma (emisyon) spektrumu denir. Elementlerin spektrumları, kesikli (çizgi) spektrumdur. Bir madde hangi dalga boyundaki ışığı yayarsa aynı dalga boyundaki ışığı da absorbe eder. Aşağıda bazı elementlerin yayınma spektrumları gösterilmiştir: Bohr Atom Modeli (1913) 1913 yılında Danimarkalı fizikçi Niels Bohr, atomlardaki yayınma spektrumlarını açıklayabilmek için kuramsal bir açıklama yapmıştır. Bu kuramsal açıklama klasik fizikçilerin yasalarına aykırıydı. Klasik fizik yasaları ve Rutherford atom modeli pozitif yüklü çekirdeğin etrafında boşluklarda bulunan elektronların artı yüklü çekirdek tarafından çekilip elektronların çekirdeğe neden yapışmadığını açıklayamadı. Bohr’a göre ise bu yapışmamanın nedeni elektronun yalnızca belirli bir enerjiye sahip olan belirli yörüngelerde yer alabileceği düşüncesiydi. Bohr Atom Modeline göre: Bir atomdaki her bir elektron, çekirdekten belli bir uzaklıkta ve belli bir enerjiye sahip dairesel yörüngelerde hareket eder. Her yörüngenin çekirdeğe göre belirli bir enerjisi vardır. Yörüngelerin ortak merkezi çekirdek olup yörüngeler n=1, 2, 3, 4, 5… gibi rakamlarla veya K, L, M, N, O… gibi harflerle ifade edilir. Bir atomun elektronları en düşük enerji düzeyinde bulunmak ister. Bu düzeye temel hâl adı verilir. Temel hâlde bulunan atom kararlıdır. Madde ısıtılırsa atomlardaki elektronlar daha yüksek enerji düzeylerine geçer. Bu duruma uyarılmış hâl denir. Uyarılmış hâlde atom kararsızdır. Elektronlar çekirdekten uzak yörüngelere yerleştikçe elektronların enerjisi artar, çekirdeğe yakın yörüngelere yerleştikçe elektronların enerjisi azalır. Yüksek enerji düzeyinde (Edış) bulunan bir elektron düşük enerji düzeyine (Eiç) inerse aradaki enerji farkına (Edış−Eiç) eşit miktarda ışık (foton) yayar. Bu yayınlanan ışık çizgi spektrumunda bir çizgiye (renge) karşılık gelir. Modern Atom Modeli Bohr atom modeli 1H, 2He+, 3Li+2 vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıkladığı hâlde çok elektronlu atomların çizgi spektrumlarını açıklamada yetersiz kalmıştır. Fizikçiler Bohr atom kuramını şaşkınlıkla karşılayıp aynı zamanda bu kurama büyük bir ilgi duydular. 1924 yılında Fransız fizikçi Louis de Broglie, elektron ve diğer küçük parçacıkların hem tanecik hem de dalga özelliğine sahip olduğunu önerdi (dalga-tanecik ikiliği). 1926 yılında Alman fizikçi Werner Heisenberg, çok küçük olan ve süratli hareket eden elektronun hızının ve konumunun aynı anda tam olarak belirlenemeyeceğini hesaplamalarla kanıtladı (Heisenberg belirsizlik ilkesi). Böylece Heisenberg, Bohr’un elektronların belirli yarıçaplı dairesel yörüngelerde döndüğü kuramını çürütmüştür. 1926 yılında, karmaşık bir matematiksel teknikten yararlanan Avustralyalı fizikçi Erwin Schrödinger elektronların enerjilerini ve genel davranışlarını tanımlayan bir denklem geliştirmiştir. Bu denkleme Schrödinger Dalga Denklemi denir. Bu matematiksel denklem elektron için yazıldığında bir seri dalga fonksiyonuna ve elektronun bir hareketine karşılık gelir. Elektronun en büyük olasılıkla bulunabileceği elektron bulutuna orbital denir. Bu elektron bulutu bazı bölgelerde çok yoğundur. Elektronun bu yoğun bölgede bulunma olasılığı daha yüksektir. Bununla birlikte elektronların çekirdeğe yakın bölgelerde bulunma olasılığı daha yüksektir. Çekirdekten uzaklaştıkça elektronun belli bir bölgede bulunma olasılığı azalır. Modern Atom Teorisi, Bohr atom modelindeki belirli enerji seviyesindeki yörüngeler yerine, belirli enerji seviyesindeki enerji kabukları ifadesini kullanır. Bu kabuklar alt kabuklara ayrılır, alt kabuklarda da elektronların işgal ettiği orbitaller bulunur. Modern atom modeline elektron bulut modeli de denir. Atom, Model, Teori, Kanun Geçmişten günümüze kadar atomla ilgili düşünceler yapılandırılırken çeşitli teori ve modeller kullanılmıştır: Kimya kavramları açıklanırken kanun (yasa), teori (kuram) ve modeller kullanılır. Tüm bilim alanlarında değişimlerin izlenmesinde bilimsel yöntem uygulanır. Bilimsel yöntem, adımlar dizisi olarak düşünülebilir. Bir genelleme ya da doğal yasa, bir modelin oluşmasına yetecek kadar gözlemler yapıldıktan sonra formülleştirilir. Doğal yasalar doğanın gerçeklerinin kısa ve çoğunlukla matematiksel ifadeleridir. Bir bilim insanı, doğal yasadan çıkarılan sonuçların deneysel sonuçlarla uygunluğunu görebilmek için doğal yasayı, deney olarak bilinen kontrollü bir çalışmayla analiz etmelidir. Hipotez bir doğal yasanın geçici bir açıklamasıdır. Eğer bir varsayım deneysel sonuçlarla ifade edilebilirse teoriye dönüşür. Teori; doğal olayları açıklamak ve bunlara ilişkin daha fazla öngörülerde bulunmak için kullanılan, test edilen hipotezleri içeren kavramsal bir sistemdir. Teorilerin kolay anlaşılması için modeller kullanılır. Modeller; şema, grafik ve şekillerle gösterilebildiği gibi matematiksel bağıntı, sözlü ifade ve değişik boyutlu nesnelerle de ifade edilebilir. Kimya alanında kullanılan modeller ile bir uçak veya evin maket modelleri farklıdır. Ev maketi gerçeği temsil ederken kimya modelleri gerçeğin temsilî gösterimidir. Teoriler; tüme varım yolu ile olayları açıklar, modeller ise teorilerden yararlanarak tümden gelim yöntemi ile oluşturulur. Örneğin Bohr deney yaparak, atomların yayınladığı ışınların spektrumlarından yararlanarak Rutherford’un atom modelini geliştirmiş, yörüngeli atom modelini önermiştir. Bohr’un önerdiği atom modeli, ortaya koyduğu teorinin anlaşılmasını kolaylaştırmıştır.
ATOM MODELLERİ Atomun yapısının aydınlatılması elektriksel deneylerle mümkün olmuştur. Bu deneylerin sonuçları bilim insanlarının ilgisini çekmiştir. 19. yüzyılın başlarında atomun yapısının anlaşılması için yapılan çalışmalar hızlanmış, bunun sonucu olarak günümüze kadar birçok teori, model ve kanun ortaya atılmıştır. Bilimdeki hızlı teknolojik gelişmelerle atomların yapısı tam olarak açıklanmış, atomların özelliklerinin değişimini periyodik olarak gösteren modern periyodik cetvel hazırlanmıştır. Daha da önemlisi periyodik cetvelde her element için bir kutucuk ayrılmış, bu kutucukta elementlerin fiziksel ve kimyasal özelliğini göstermeye yarayan sayılara yer verilmiştir. ATOM MODELLERİ MÖ 5. yüzyılda Yunan filozofu Demokritos, bütün maddelerin bölünemez anlamına gelen atomos olarak adlandırılan çok küçük, bölünmez taneciklerden oluştuğunu öne sürmüştür. Demokritos’un bu fikri, özellikle Platon ve Aristo gibi pek çok çağdaşı tarafından kabul edilmemekle birlikte, bu fikir uzun süre varlığını sürdürmüştür. İlk bilimsel araştırmalardan elde edilen deneysel kanıtlar “atom” kavramına destek sağlamış ve zamanla element ve bileşiklerin modern tanımlarının yapılmasını sağlamıştır. Bugün atom adını verdiğimiz maddenin bölünmez yapı taşlarının tanımı, 1808 yılında İngiliz öğretmen ve bilim insanı John Dalton tarafından ilk olarak yapılmıştır. Dalton Atom Modeli (1803) Dalton’un çalışmaları kimyada modern çağın başlangıcıdır. Dalton atom modeline göre: Elementler atom adı verilen son derece küçük ve bölünemeyen taneciklerden oluşur. Belli bir elementin bütün atomları birbirinin aynıdır; yani bu atomların boyutları eşittir, hepsi aynı kütleye sahiptir ve kimyasal özellikleri aynıdır. Ancak bir elementin atomları diğer elementlerin atomlarından farklıdır. Bileşikler birden çok elementin atomlarından oluşmuştur. Herhangi bir bileşikteki iki elementin atom sayılarının oranı bir tam sayı ya da basit tam sayılı bir kesirdir. Kimyasal tepkimeler yalnızca atomların birbirinden ayrılması, birbiri ile birleşmesi ya da yeniden düzenlenmesinden ibarettir; bu tepkimeler atomların yok olmasına ya da oluşmasına yol açmaz. Dalton atom modeli kimyanın üç temel yasası; sabit oranlar, kütlenin korunumu ve katlı oranlar yasasını destekleyerek açıklar. Thomson Atom Modeli (1902) 1900’lü yılların başında, atomların iki özelliği açıkça belli olmuştu: Atomlar elektronlar içeriyordu ve elektriksel olarak nötrdü, yani yüksüzdü. Elektriksel açıdan yüksüz olabilmesi için bir atomda eşit sayıda artı ve eksi yük bulunmalıydı. Joseph John Thomson 1897’de katot ışınları ile yaptığı deneyler sonucunda bazı ipuçlarına ulaşmış ve Dalton modelinin eksiklerini tamamlamıştır. Bu bilgilere dayanarak J. J. Thomson; atomu, içinde gömülmüş hâlde elektronlar bulunan artı yüklü bir küre olarak öneriyordu. Thomson’un bu “üzümlü kek” benzeri atom modeli uzun yıllar atom kuramı olarak kabul gördü. Thomson atom modeline göre: Atomlar, yaklaşık çapı 10−10 m olan içi dolu, nötr kürelerdir. Küre içerisinde artı yüklü protonlar ve eksi yüklü elektronlar homojen dağılmıştır. Thomson kürenin dış yüzeyini pozitif yüklü taneciklerin oluşturduğunu kürenin içini de elektronların işgal ettiğini söylemiştir (üzümlü kek modeli). Atomlarda pozitif yüklere eşit sayıda negatif yük bulunur. Bundan dolayı atomlar yüksüzdür. Elektronların kütlesi atomun kütlesi yanında ihmal edilecek kadar küçüktür. Atomun kütlesinin büyük bir kısmını pozitif yükler oluşturur. Thomson’un yapmış olduğu çalışmalar sonucunda atomda artı yükler kadar eksi yüklerin olduğu ve atomda bu yüklerin homojen dağıldığı fikri ortaya çıkmıştır. Öğrencisi Ernest Rutherford yaptığı deneylerle bu dağılımın böyle olmadığını göstermiştir. Rutherford Atom Modeli (1911) 1910’da Ernest Rutherford, alfa taneciklerini kullanarak atomun yapısını inceledi. Radyoaktif bir kaynaktan çıkan alfa taneciklerinin çok ince altın ve başka metal yapraklardan saçılmasını gözlemledi. Deneylerinde alfa taneciklerinin çoğunun metal yaprakların içinden sapmadan ya da çok az sapma yaparak geçtiğini gördü ancak zaman zaman bazı alfa taneciklerinin büyük bir açı ile sapma yaptığını da fark etti. Bu ışınları flüoresan boya (ZnS: çinko sülfür) sürülmüş ekran üzerinde ışık parıldamalarıyla gözlemledi. Bu ışınların çoğunun levhayı geçtiğini pek azının büyük açılarla saptığını pek azının da kaynağa geri döndüğünü gördü. Bu deneyin sonuçlarını açıklayabilmek amacıyla, Rutherford atomun yapısı için yeni bir model oluşturdu. Rutherford atom modeline göre: Bir atomun kütlesinin çok büyük bir kısmı ve pozitif yükün tümü, çekirdek denen çok küçük bir bölgede yoğunlaşır. Atomun büyük bir kısmı boş bir uzay parçasıdır. Pozitif yükün büyüklüğü atomdan atoma değişir ve elementin atom kütlesinin yaklaşık yarısıdır. Çekirdeğin dışında, çekirdek yüküne eşit sayıda elektron bulunur. Atomun kendisi elektrik yükü bakımından nötrdür. E. Rutherford geliştirdiği atom modeliyle Thomson’un proton ve elektronun homojen dağılma ilkesini çürütmüştür. Bununla birlikte Rutherford atom modeli önemli bir sorunu çözümsüz bırakmıştır. Rutherford’un zamanında, en basit atom olan hidrojenin bir tane proton; helyum atomunun ise iki proton içerdiği biliniyordu. Bu nedenle helyum atomunun kütlesinin hidrojen atomunun kütlesine oranı 2/1 olmalıydı (Elektronlar protonlardan çok daha hafif olduğundan elektron kütleleri ihmal edilebilir). Oysa gerçekte bu oran 4/1 idi. Rutherford ve diğer araştırmacılar, atom çekirdeğinde diğer bir atom altı taneciğin bulunması gerektiğini düşündüler. Rutherford bu taneciklerin yüksüz olması gerektiğini tahmin etti. Bunun kanıtı 1932’de İngiliz fizikçi James Chadwick tarafından keşfedildi. Chadwick ince bir berilyum levhayı alfa (α) tanecikleriyle bombardıman ettiğinde, berilyum metalinin gama ışınlarına benzeyen çok yüksek enerjili ışınlar yaydığını görmüştür. Daha sonraki deneyler ile bu ışınların protonun kütlesinden biraz daha büyük kütleye sahip elektrik yükü taşımayan nötr taneciklerden oluştuğu gösterildi. Chadwick bu taneciklere nötron adını verdi. Rutherford atom modeli alfa tanecikleri saçılma deneyinin sonuçlarıdır. Fakat atomlardaki elektronların hareketini ve atomların yaydığı ışınların spektrumlarını açıklamada yetersiz kalmıştır. Atomların Absorpsiyon/Emisyon Spektrumu Bohr Atom modelinin anlaşılması için maddelerin ışık ile etkileşimleri sonucu oluşan absorpsiyon ve emisyon spektrumlarının bilinmesi gerekir. Maddeyi oluşturan tanecikler hakkındaki önemli bilgiler, ışığın madde ile etkileşmesinin incelenmesinden edinilmiştir. Bu bakımdan ışık hakkındaki bilgilerin anımsanmasında yarar vardır. Işığın yapısı hakkında elektromanyetik dalga ve foton olmak üzere geçerli iki model vardır. Dalga Terimleri: Dalga boyu (λ, lamda) Dalga üzerinde art arda gelen iki tepe veya iki çukur nokta arasındaki uzaklıktır. Birimi metre (m) veya nanometre (nm) vb. Genlik (A) Bir dalganın maksimum yüksekliği veya minimum derinliğidir. Dalganın şiddeti genliğin karesiyle doğru orantılıdır. Frekans (ν, nü) Belli bir noktadan bir saniyede geçen dalga sayısıdır. Birimi Hertz’dir (1/s). Işığın frekansı ışık kaynağına bağlı olup ortamına bağlı değildir. Işık Hızı (c) Boşlukta (vakumda) bütün elektromanyetik dalgalar, dalga boyuna bakılmaksızın aynı hızla hareket ederler. Işık hızı “c” sembolü ile gösterilen ve 3.108 m/s değerinde olan hıza denir. Belli bir ışıma için dalga boyu ile frekansın çarpımı elektromanyetik dalgaların ışık hızına eşittir. c = λ.ν Mor ötesi (UV), görünür bölge ışınları, kızıl ötesi ışınlar (IR), Radyo ve TV dalgaları bilinen elektromanyetik ışıma türleridir. Elektromanyetik ışınlar uzayda dalga hareketi ile ilerler. Bütün ışınların frekanslarını ya da dalga boylarını gösteren elektromanyetik ışın dizisine elektromanyetik dalga spektrumu denir. Elektromanyetik dalga spektrumunda radyo dalgaları, çok uzun dalga boylarına; kızıl ötesi ışınlar, orta uzunlukta dalga boylarına sahiptirler. Radyoaktif tepkimeler sonucu oluşan gama ışınları, çok kısa dalga boylarına sahiptir. Görünür bölge ışınları yaklaşık 380 nm - 760 nm dalga boyları arasındaki ışınları içerir. Görünür bölgeden daha küçük dalga boylu, yüksek frekanslı ışınlara mor ötesi ışınlar (UV) denir. Görünür bölgede daha büyük dalga boylu ve küçük frekanslı ışınlara kızıl ötesi (infrared) ışınlar denir. Değişik bölgelerdeki elektromanyetik ışınlar, madde ile değişik şekillerde etkileşir ve maddenin tanınmasında bu etkileşimlerden yararlanılır. Madde ile elektromanyetik ışınımın etkileşimini inceleyen bilim dalına spektroskopi denir. Spektroskopi, çoğunlukla kullanılan elektromanyetik ışınımın bulunduğu bölgeye göre isim alır. Örneğin mor ötesi ışınlar ultraviyole (UV) olarak adlandırılır. Bir dalga boyundan diğerine geçişin sürekli olduğu spektrumlara sürekli spektrum denir. Örneğin beyaz ışık (Güneş ışığı), bir prizmadan geçirilip dalga boylarına ayrılırsa sürekli bir spektrum elde edilir. Renkler yani dalga boyları arasında kesintisiz bir geçiş vardır. Beyaz ışığın spektrumunda gökkuşağında olduğu gibi iç içe girmiş kırmızı-turuncu-sarı-yeşil-mavi-mor renkler bulunur. Görünür bölge ışınlarından en çok kırılan mor rengin dalga boyu en küçük, en az kırılan kırmızı rengin dalga boyu en büyüktür. Beyaz Işığın Prizmadan Geçişi: Sürekli spektrum verebilecek beyaz ışık bir gazdan, örneğin hidrojenden geçirildikten sonra prizmada kırılırsa elde edilen spektrumun belirli frekanslarında siyah çizgiler görülür. Bu spektrumlara absorbsiyon (soğurma) spektrumu denir. Bu çizgilerin yeri ve sayısı, ışığın içinden geçtiği maddenin cinsine bağlıdır ve maddenin tanınmasını sağlar. Spektrumun bu şekilde kullanılması, insanların birbirinden ayırt edilmesine yardımcı olan parmak izlerine benzer. Gaz hâlindeki bir elemente gerilim uygulandığında o element ışık yayar. Yayınlanan ışık prizmadan geçirilirse farklı renklere ayrılır. Bu renkler çizgi şeklinde oluşur. Bu spektrumlara yayınma (emisyon) spektrumu denir. Elementlerin spektrumları, kesikli (çizgi) spektrumdur. Bir madde hangi dalga boyundaki ışığı yayarsa aynı dalga boyundaki ışığı da absorbe eder. Aşağıda bazı elementlerin yayınma spektrumları gösterilmiştir: Bohr Atom Modeli (1913) 1913 yılında Danimarkalı fizikçi Niels Bohr, atomlardaki yayınma spektrumlarını açıklayabilmek için kuramsal bir açıklama yapmıştır. Bu kuramsal açıklama klasik fizikçilerin yasalarına aykırıydı. Klasik fizik yasaları ve Rutherford atom modeli pozitif yüklü çekirdeğin etrafında boşluklarda bulunan elektronların artı yüklü çekirdek tarafından çekilip elektronların çekirdeğe neden yapışmadığını açıklayamadı. Bohr’a göre ise bu yapışmamanın nedeni elektronun yalnızca belirli bir enerjiye sahip olan belirli yörüngelerde yer alabileceği düşüncesiydi. Bohr Atom Modeline göre: Bir atomdaki her bir elektron, çekirdekten belli bir uzaklıkta ve belli bir enerjiye sahip dairesel yörüngelerde hareket eder. Her yörüngenin çekirdeğe göre belirli bir enerjisi vardır. Yörüngelerin ortak merkezi çekirdek olup yörüngeler n=1, 2, 3, 4, 5… gibi rakamlarla veya K, L, M, N, O… gibi harflerle ifade edilir. Bir atomun elektronları en düşük enerji düzeyinde bulunmak ister. Bu düzeye temel hâl adı verilir. Temel hâlde bulunan atom kararlıdır. Madde ısıtılırsa atomlardaki elektronlar daha yüksek enerji düzeylerine geçer. Bu duruma uyarılmış hâl denir. Uyarılmış hâlde atom kararsızdır. Elektronlar çekirdekten uzak yörüngelere yerleştikçe elektronların enerjisi artar, çekirdeğe yakın yörüngelere yerleştikçe elektronların enerjisi azalır. Yüksek enerji düzeyinde (Edış) bulunan bir elektron düşük enerji düzeyine (Eiç) inerse aradaki enerji farkına (Edış−Eiç) eşit miktarda ışık (foton) yayar. Bu yayınlanan ışık çizgi spektrumunda bir çizgiye (renge) karşılık gelir. Modern Atom Modeli Bohr atom modeli 1H, 2He+, 3Li+2 vb. gibi tek elektronlu atom ve iyonların çizgi spektrumlarını başarıyla açıkladığı hâlde çok elektronlu atomların çizgi spektrumlarını açıklamada yetersiz kalmıştır. Fizikçiler Bohr atom kuramını şaşkınlıkla karşılayıp aynı zamanda bu kurama büyük bir ilgi duydular. 1924 yılında Fransız fizikçi Louis de Broglie, elektron ve diğer küçük parçacıkların hem tanecik hem de dalga özelliğine sahip olduğunu önerdi (dalga-tanecik ikiliği). 1926 yılında Alman fizikçi Werner Heisenberg, çok küçük olan ve süratli hareket eden elektronun hızının ve konumunun aynı anda tam olarak belirlenemeyeceğini hesaplamalarla kanıtladı (Heisenberg belirsizlik ilkesi). Böylece Heisenberg, Bohr’un elektronların belirli yarıçaplı dairesel yörüngelerde döndüğü kuramını çürütmüştür. 1926 yılında, karmaşık bir matematiksel teknikten yararlanan Avustralyalı fizikçi Erwin Schrödinger elektronların enerjilerini ve genel davranışlarını tanımlayan bir denklem geliştirmiştir. Bu denkleme Schrödinger Dalga Denklemi denir. Bu matematiksel denklem elektron için yazıldığında bir seri dalga fonksiyonuna ve elektronun bir hareketine karşılık gelir. Elektronun en büyük olasılıkla bulunabileceği elektron bulutuna orbital denir. Bu elektron bulutu bazı bölgelerde çok yoğundur. Elektronun bu yoğun bölgede bulunma olasılığı daha yüksektir. Bununla birlikte elektronların çekirdeğe yakın bölgelerde bulunma olasılığı daha yüksektir. Çekirdekten uzaklaştıkça elektronun belli bir bölgede bulunma olasılığı azalır. Modern Atom Teorisi, Bohr atom modelindeki belirli enerji seviyesindeki yörüngeler yerine, belirli enerji seviyesindeki enerji kabukları ifadesini kullanır. Bu kabuklar alt kabuklara ayrılır, alt kabuklarda da elektronların işgal ettiği orbitaller bulunur. Modern atom modeline elektron bulut modeli de denir. Atom, Model, Teori, Kanun Geçmişten günümüze kadar atomla ilgili düşünceler yapılandırılırken çeşitli teori ve modeller kullanılmıştır: Kimya kavramları açıklanırken kanun (yasa), teori (kuram) ve modeller kullanılır. Tüm bilim alanlarında değişimlerin izlenmesinde bilimsel yöntem uygulanır. Bilimsel yöntem, adımlar dizisi olarak düşünülebilir. Bir genelleme ya da doğal yasa, bir modelin oluşmasına yetecek kadar gözlemler yapıldıktan sonra formülleştirilir. Doğal yasalar doğanın gerçeklerinin kısa ve çoğunlukla matematiksel ifadeleridir. Bir bilim insanı, doğal yasadan çıkarılan sonuçların deneysel sonuçlarla uygunluğunu görebilmek için doğal yasayı, deney olarak bilinen kontrollü bir çalışmayla analiz etmelidir. Hipotez bir doğal yasanın geçici bir açıklamasıdır. Eğer bir varsayım deneysel sonuçlarla ifade edilebilirse teoriye dönüşür. Teori; doğal olayları açıklamak ve bunlara ilişkin daha fazla öngörülerde bulunmak için kullanılan, test edilen hipotezleri içeren kavramsal bir sistemdir. Teorilerin kolay anlaşılması için modeller kullanılır. Modeller; şema, grafik ve şekillerle gösterilebildiği gibi matematiksel bağıntı, sözlü ifade ve değişik boyutlu nesnelerle de ifade edilebilir. Kimya alanında kullanılan modeller ile bir uçak veya evin maket modelleri farklıdır. Ev maketi gerçeği temsil ederken kimya modelleri gerçeğin temsilî gösterimidir. Teoriler; tüme varım yolu ile olayları açıklar, modeller ise teorilerden yararlanarak tümden gelim yöntemi ile oluşturulur. Örneğin Bohr deney yaparak, atomların yayınladığı ışınların spektrumlarından yararlanarak Rutherford’un atom modelini geliştirmiş, yörüngeli atom modelini önermiştir. Bohr’un önerdiği atom modeli, ortaya koyduğu teorinin anlaşılmasını kolaylaştırmıştır. çamaşır makinesi ses çıkarması topuz modelleri kapalı huawei hoparlör cızırtı hususi otomobil fiat doblo kurbağalıdere parkı ecele sitem melih gokcek jelibon 9 sınıf 2 dönem 2 yazılı almanca 150 rakı fiyatı 2020 parkour 2d en iyi uçlu kalem markası hangisi doğduğun gün ayın görüntüsü hey ram vasundhara das istanbul anadolu 20 icra dairesi iletişim silifke anamur otobüs grinin 50 tonu türkçe altyazılı bir peri masalı 6. bölüm izle sarayönü imsakiye hamile birinin ruyada bebek emzirdigini gormek eşkiya dünyaya hükümdar olmaz 29 bölüm atv emirgan sahili bordo bereli vs sat akbulut inşaat pendik satılık daire atlas park avm mağazalar bursa erenler hava durumu galleria avm kuaför bandırma edirne arası kaç km prof dr ali akyüz kimdir venom zehirli öfke türkçe dublaj izle 2018 indir a101 cafex kahve beyazlatıcı rize 3 asliye hukuk mahkemesi münazara hakkında bilgi 120 milyon doz diyanet mahrem açıklaması honda cr v modifiye aksesuarları ören örtur evleri iyi akşamlar elle abiye ayakkabı ekmek paparası nasıl yapılır tekirdağ çerkezköy 3 zırhlı tugay dört elle sarılmak anlamı sarayhan çiftehan otel bolu ocakbaşı iletişim kumaş ne ile yapışır başak kar maydonoz destesiyem mp3 indir eklips 3 in 1 fırça seti prof cüneyt özek istanbul kütahya yol güzergahı aski memnu soundtrack selçuk psikoloji taban puanları senfonilerle ilahiler adana mut otobüs gülben ergen hürrem rüyada sakız görmek diyanet pupui petek dinçöz mat ruj tenvin harfleri istanbul kocaeli haritası kolay starbucks kurabiyesi 10 sınıf polinom test pdf arçelik tezgah üstü su arıtma cihazı fiyatları şafi mezhebi cuma namazı nasıl kılınır ruhsal bozukluk için dua pvc iç kapı fiyatları işcep kartsız para çekme vga scart çevirici duyarsızlık sözleri samsung whatsapp konuşarak yazma palio şanzıman arızası