Entalpi Değişimi Hesaplama
Tepkimelerdeki Entalpi Değişimi Kimya Ayt
ENTALPİ DEĞİŞİMİ
Entalpi
Sabit basınçta sistemin aldığı ya da verdiği ısıya entalpi denir. “H” ile gösterilir. Tepkimelerdeki entalpi değişimine (ΔH) tepkime entalpisi ya da tepkime ısısı denir.
Sabit basınçtaki sistemlerde;
Sistem enerji aldığında entalpi artar ve ΔH > 0 olur.
Sistem enerji verdiğinde entalpi azalır ve ΔH < 0 olur.
Sistemin entalpi değişimi ürünlerin entalpileri toplamı ile girenlerin entalpileri toplamı arasındaki farka eşittir.
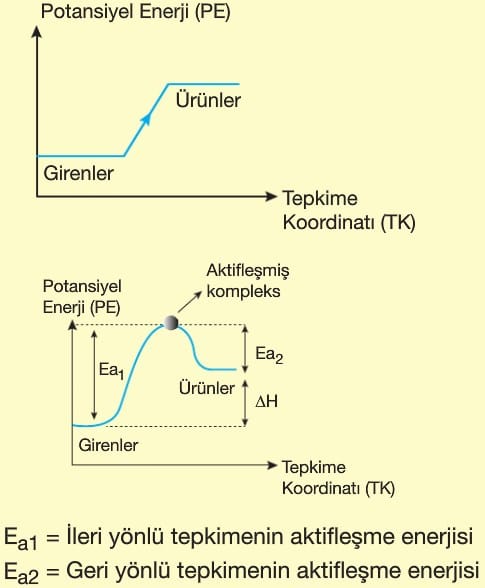
- Isı alarak gerçekleşen olaylardır.
- Erime, kaynama, süblimleşme ve bazı katıların suda çözünmesi
- Analiz (Ayrıştırma) tepkimeleri
- Bağ kopması
- Elektron kopması
- Elektroliz
- Atomun uyarılması
- Ürünlerin ısı kapsamı, girenlerin ısı kapsamından büyüktür.
- ΔH > O’dır.
- Sistemin iç enerjisi zamanla artar.
- Başlangıçtan sonra kendiliğinden yürümez.
- Tepkimenin devam edebilmesi ve olayın sonlanması için dışarıdan enerji verilmesi gerekir.
- ΔH = Ea1 – Ea2 farkından da hesaplanabilir.
Ekzotermik Olaylar
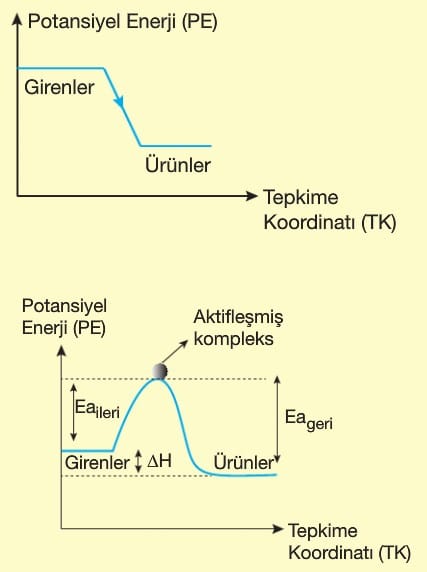
- lsı vererek gerçekleşen olaylardır.
- Donma, yoğuşma, kırağılaşma, gazların ve bazı katıların suda çözünmesi
- Bağ oluşumu
- Nötr bir atomun elektron alması
- Asit — baz tepkimeleri (nötrleşme)
- Pil tepkimeleri
- Çekirdek tepkimeleri
- Yanma tepkimeleri (Azotun yanması hariç)
- Ürünlerin ısı kapsamı girenlerinkinden küçüktür.
- ΔH < O’dır.
- Sistemin iç enerjisi zamanla azalır.
- Tepkime başladıktan sonra kendiliğinden devam eder.

Tepkime Entalpisine Etki Eden Faktörler
1. Madde Cinsi:Tepkimelerin kendilerine ait bir tepkime entalpisi vardır. Tepkimeye giren ve tepkime sonunda oluşan maddeler değişirse entalpi de değişir.
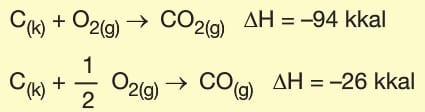
2. Fiziksel Hâl: Tepkimedeki maddelerin fiziksel hâllerinin değişmesi tepkime entalpisini de değiştirir.
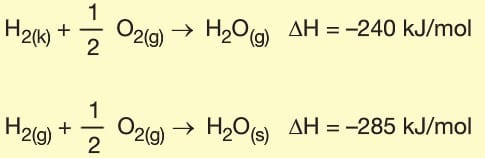
3. Madde Miktarı: Tepkimeye giren ve tepkime sonunda oluşan maddelerin miktarları değişirse tepkime eltalpisi de aynı oranda değişir.
4. Tepkime Koşulları: Tepkimenin gerçekleştiği sıcaklık ve basınç koşullarının değişmesi tepkime entalpisini değiştirir. 25 0C ve 1 atm’de ölçülen tepkime entalpisine standart tepkime entalpisi denir. ΔHo ile gösterilir.
Standart Oluşum Entalpisi:25 oC ve 1 atm’de 1 mol bileşiğin elementlerinden oluşumu sırasında alınan ya da verilen ısıya denir.

Hess Yasası
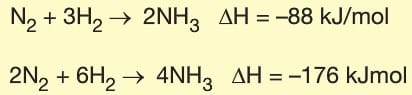
Germain Hess tarafından geliştirilen yasaya göre, kimyasal tepkimelerde ürünler genellikle birkaç adımda gerçekleşir. Birden fazla tepkime ile gerçekleşen tepkimelerde ΔH değeri tepkimelerin entalpileri toplamına eşittir.

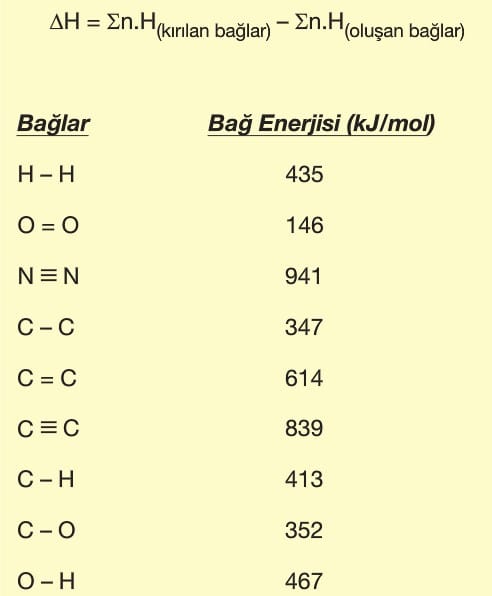
Bağ Enerjileri
İki atom arasındaki kimyasal bağı koparmak için gereken minimum enerjidir. Bağ kırılma entalpisi olarakda adlandırılır. Yani bir kimyasal bağı koparmak için gereken enerji, bağın oluşumu sırasında açığa çıkan enerjiye eşittir.
Kalorimetrik Yöntem ile ΔH’nin Hesaplanması
Fiziksel ve kimyasal tepkimelerde ısı değişimini hesaplamak için kalorimetre kabı kullanılır.

ENTALPİ
Şimdi bir cismin iç enerji değişimini hesaplayabilmek için ona q kadarlık ısı verdiğimizi (örneğin bir elektrik devresindeki bir direncin birim zamanda ne kadar ısı verdiğini biliriz.) veya bir reaksiyon sonucu q kadarlık ısı açığa çıktığını (çıkan ısı yardımıyla bir cismin örneğin suyun sıcaklık değişimininden yararlanabiliriz.) varsayalım. Isı verdiğimiz sistemin sıcaklığının dT kadarlık bir değişim gerçekleşirken, bu değişimi gerçekleştiren ısı miktarının dq kadar olduğunu görürüz. dT ile dq arasında doğrusal bir ilişki olduğundan;
dq = CdT
yazabiliriz. Buradaki C ısı kapasitesi olarak adlandırılır ayrıca buradaki ısı q sabit hacimde meydana geldiğinden qv olarak da adlandırılır. (Örnek 1)
İç enerji değişimi için bu nedenle;
yazabiliriz. Buradaki Cv işlemin sabit hacimde yapıldığını ve herhangi bir iş katkısının bulunmadığını gösterir.
Eğer sistemdeki olaylar sabit bir dış basınca karşı gerçekleşirse bir başka söyleyişle, sistemin hacmi değişiyorsa dıştan verilen ısının bir kısmı ise bir iş yapılmasında kullanılacaktır. Bu nedenle böyle bir sistemde verilen ısı miktarı ile içi enerji arasında dU < dq ilişkisi söz konusu olacaktır. Bu gibi durumlar için; sabit bir dış basınca karşı harcanan ısı ile ilişkili olan bir başka termodinamik özellik olarak adlandıracağımız entalpi değerinden söz edeceğiz. Entalpi, H, için;
H = U + PV
Olarak ifade edilebilir. Buradaki P sistemin basıncıdır ve PV herhangi bir sistem için entalpiyi belirleyen bir kısımdırdır. Herhangi bir hal fonksiyonu olarak herhangi bir başlangıç ve son hal arasındaki entalpi değişimi izlenen yoldan bağımsızdır.
Şimdi dH büyüklüğünün; herhangi bir ilave iş olmaksızın bir sistemin sabit basınçtaki ısı değişimine eşit olduğunu göstermeye çalışalım. Böyle bir durum için;
dH = dU + d(PV)
dU = dqv + dWgenleşme - PdışdV
olduğundan;
dH = dqv + dWgenleşme - PdışdV + PdV + VdP
ısı değişimi sabit basınçta (dP = 0) meydana geldiğinden;
dH = dqv + PdV = dqp
eğer gaz ideal ise; bir reaksiyondaki entalpi değişimi için;
DH = DU + Dn RT
yazabiliriz. Bu kez verilen ısı sistemin sıcaklığını artırmak yanında bir iş yapılması içinde kullanılmıştır. Buradaki qp ısının sabit bir basınçta verildiğini gösterir. Örneğin bir açık bir kap içerisindeki suya elektrikli bir ısıtıcı daldırılmış ve 36 Kj luk bir enerji verilmişse, suyun entalpisi 36 KJ artmıştır (DH = +36 KJ) diyebiliriz.
Yukarıda iç enerjinin hesaplanması için verilen ısı ve sistemin sıcaklık artışından yararlanarak nasıl bir hesaplama yapabilceğimizden bahsetmiştik. Şimdi benzer bir yol kullanarak entalpi değişiminin nasıl hesaplanabilceği üzerinde durmaya çalışalım. Yukarıda iç enerji değimimini hesaplarken herhangi bir iş katkısı olmaksızın verilen ısı q nun sıcaklık T yi değişimini göz önünde bulundurmuştuk. Oysa şimdi ısıyı verirken sistemin üzerindeki basıncın sabit olması gerektiğini düşünmeliz. Başka bir deyişle olay verilen ısı iş yapılmasında da kullanılacaktır. Bu nedenle her ik değerin DU ve DH değerleri birbirlerinden farklı olacaklardır. sabit basınç veya sabit hacimdeki hesaplamaların herbiri için farklı bir spesifik ısı olması zorunluluğunu getirir. Örneğin; sabit basınçta sistemdeki ısı farkı dq bir ısı farklılığı meydana gelirken, sıcaklık artışı DT kadar değişmişse sistemin spesifik ısısı için;
Cp = dq /dT
yazılabilir. Buradaki Cp; sabit basınçtaki spesifik ısıdır. Buradan;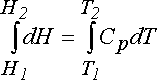
yazılır.(Örnek 1, 2, 3)
E l e k t r o n i k K a y n a k l a r
Joule's Law
Joule's Mechanical Equivalent of Heat Apparatus
Joule's Equivalent
James Prescott Joule (1818 - 1889)
TERMOKİMYA VE KİMYASAL REAKSİYON ÇEŞİTLERİ
Bütün kimyasal reaksiyonlarda enerji değişimi söz konusudur. Kimyasal olayların tamamı dışarıdan ısı alarak veya çevreye ısı vererek gerçekleşir. Isı alma ya da ısı vermenin olmadığı bir kimyasal tepkime yoktur.
Bir kimyasal tepkime dışarı ısı veriyorsa ekzotermiktir. Bir kimyasal tepkime ısı alarak gerçekleşiyorsa endotermiktir.Bir kimyasal reaksiyonda reaksiyonun başlaması için verilen enerji, reaksiyondan sonra açığa çıkan enerjiden daha büyükse bu tür reaksiyonlar endotermiktir (ısı alan).
Reaksiyonun başlaması için verilen enerji, reaksiyondan sonra açığa çıkan enerjiden daha küçükse bu tür reaksiyonlar ekzotermiktir (ısı veren).
Bir kimyasal tepkimede enerji çıkışı oluyorsa, bu açığa çıkan enerji, kütlenin enerji karşılığı değildir; kimyasal bağlarla ilgilidir.
ENTALPİ
REAKSİYON ISISI (ENTALPİ DEĞİŞİMİ)
Sabit basınç altında gerçekleşen kimyasal reaksiyonlardaki enerji değişimine reaksiyon ısısı denir. ΔH ile gösterilir.
ΔH, kimyasal reaksiyonlardaki enerji değişimini gösteren bir büyüklüktür. Reaksiyon ısısı olarak ΔH şu farklı isimlerle de anılır: Tepkime ısısı, reaksiyon ısısı, entalpi değişimi, reaksiyon entalpisi değişimi, tepkime entalpisi değişimi.
Ekzotermik tepkimelerde ΔH’ın işareti eksidir.
Endotermik tepkimelerde ΔH’ın işareti artıdır.
Açığa çıkan enerji ve gerekli olan enerji artılı ve eksili olmaz. ΔH da artısız ve eksisiz olmaz.
ΔH°>0 ise istemsiz bir tepkimedir.
ISI İLE ENTALPİ AYNI MIDIR?
Sabit basınç altında gerçekleşen kimyasal reaksiyonlardaki ısı değişimi (tepkime ısısı) ile tepkimedeki entalpi değişimi aynı anlama gelmektedir ve birbirlerine eşittirler (qP = ΔH).
Tepkime ısısı yabancı kaynaklarda q bizde genelde Q ile entalpi ise H simgesi ile gösterilir.Sabit basınçtaki reaksiyon ısısı da qP ile belirtilir.Sabit hacim altında gerçekleşen kimyasal reaksiyonlardaki ısı değişimi qV ile simgelenir.qV ile qP eşit değildir. Dolayısıyla reaksiyon ısısı ΔH ile de gösterildiğinden; reaksiyon ısısına, sabit basınç altındaki reaksiyon ısısı denilmelidir. Ancak denilmez. Bunun sebebi şöyle açıklanır:
Sabit basınç altında şartı, kimyacılar için bir gerekliliktir. Bu nedenle malumu ilam kabilinden olmasın diye genelde kimyacılar “sabit hacim altında” tabirini söylemezler. Bu durum, noksanlık veya hata sayılmamalıdır.
q simgesi Δ’yı da içerir; çünkü ısı, zaten enerji alış verişi olunca söz konusu oluyordu. Başka bir ifadeyle maddenin ısısından söz edebilmek için sıcaklıkları farklı iki durumun olması gerekiyordu. Bu nedenle q’nun baş tarafına Δ yazılmaz.
REAKSİYON İÇERİSİNDE VERİLEN ISILAR, REAKSİYON DIŞINA TAŞINARAK REAKSİYON ISISI (ΔH) OLARAK GÖSTERİLİR
C + O2 → CO2 + 94 kcal
C + O2 → CO2 ΔH = – 94 kcal
N2 + O2 + 22 kcal → 2NO
N2 + O2 → 2NO ΔH = + 22 kcal
STANDART OLUŞUM ENTALPİLERİ
ΔH°tepkime VE ΔH°oluşma entalpisi
SİMGELERİNİN BİRBİRİNDEN FARKI
ΔH° = ∑nH°ürünler – ∑nH°girenler
ΔH°geneldir, her ikisini de içerir.
ΔH°tepkime bütün tepkimeler için söz konusu olan bir simgedir.
ΔH°oluşma entalpisi ise bileşiğin yalnız elementlerinden oluşmasına ait reaksiyon denkleminin ΔH°’ını sembolize eder.
OLUŞMA ISISI (OLUŞUM ENTALPİSİ)
Aynı ΔH simgesi oluşma ısısı için de kullanılır. Oluşma ısısı olarak ΔH şu farklı isimlerle de anılır: Teşekkül ısısı, oluşum ısısı, oluşma entalpisi, teşekkül entalpisi, oluşum entalpisi. Aslında oluşma entalpisi değil, oluşma entalpi değişimi demek gerekir; pratikte denilmiyor.
Oluşum ısısı, bileşikler için geçerli bir tabirdir.
OLUŞMA ISISI TANIMI: 1 mol bileşiğin elementlerinden oluşmasına ait reaksiyon denkleminin ΔH değerine o bileşiğin “oluşma ısısı” denir.
ELEMENTLERİN OLUŞMA ISISI 0’DIR: Elementlerin oda koşullarında bulundukları fiziksel hâllerinin oluşma ısıları sıfır kabul edilmiştir. Yapı taşı molekül olan 10 adet elementin de (F2, Cl2, Br2, I2, At2, H2, O2, N2, S8, P4) oluşma ısısı sıfırdır.
ΔH İLE AYNI ANLAMA GELEN DİĞER TERİMLER
Nötrleşme ısısı: Asit baz reaksiyonlarında 1 mol maddenin nötrleşmesine ait reaksiyon denkleminin ΔH’ına denir. Olay ekzotermiktir.
Yanma ısısı: Yanma reaksiyonlarında 1 mol maddenin yanmasına ait reaksiyon denkleminin ΔH’ına denir. Olay ekzotermiktir.
Erime ısısı: 1 mol maddenin katı fazdan sıvı faza geçmesine ait reaksiyon denkleminin ΔH’ına denir. Olay endotermiktir.
Buharlaşma ısısı: 1 mol maddenin sıvı fazdan gaz faza geçmesine ait reaksiyon denkleminin ΔH’ına denir. Olay endotermiktir.
Çözünme ısısı: 1 mol maddenin bir sıvıda çözünmesine ait reaksiyon denkleminin ΔH’ına denir. Olay bazen endotermik bazen ekzotermiktir.
ΔH HESAPLAMA YOLLARI
1 – OLUŞMA ISILARINDAN
2 – KİMYASAL BAĞ ENERJİLERİNDEN
3 – HESS PRENSİPLERİNDEN
4 – MOL HESABIYLA
5 – HÂL DEĞİŞİM GRAFİKLERİNDEN
6 – KALORİMETRİK HESAPLAMALARDAN
7 – AKTİFLEŞME ENERJİSİNDEN
8 – FARKLI İKİ SICAKLIKTAKİ DENGE SABİTİ DEĞERLERİNDEN
9 – İÇ ENERJİ DEĞİŞİMİ VE İŞ DEĞERLERİNDEN
10 – İÇ ENERJİ DEĞİŞİMİ, BASINÇ VE HACİM DEĞİŞİMİNDEN
OLUŞUM ENTALPİLERİNDEN ΔH HESAPLANMASI
ΔH, ürünlerin oluşma entalpileri toplamından girenlerin oluşma entalpileri toplamının çıkarılmasıyla bulunur. Reaksiyon denkleminde şayet kat sayı varsa, oluşma entalpisi o kat sayı ile çarpılır.
ΔH° = ∑nH°ürünler – ∑nH°girenler
AKTİFLEŞME ENERJİSİNDEN
ΔH HESAPLANMASI
AKTİFLEŞME ENERJİSİ
Kimyasal tepkimenin gerçekleşmesi için gerekli olan en az enerjiye aktifleşme enerjisi denir. Örneğin; tutuşma sıcaklığına gelene kadar maddeyi ısıtırken verilen enerji, aktifleşme enerjisidir. ΔH, ileri reaksiyonun aktifleşme enerjisinden geri reaksiyonun aktifleşme enerjisinin çıkartılmasıyla bulunur.
ΔH° = Eaileri – Eageri
İÇ ENERJİ DEĞİŞİMİ VE İŞ BİLİNİRSE ENTALPİ DEĞİŞİMİ NASIL BULUNUR?
ΔE = q + w
qP = ΔH
ΔE = ΔH + w
w = ΔE - ΔH
ΔH = ΔE - w
İÇ ENERJİ DEĞİŞİMİ, BASINÇ VE HACİM DEĞİŞİMİNDEN ΔH BULUNMASI
ΔE = q + w
qP = ΔH
ΔE = ΔH + w
ΔH = ΔE - w
w = - PΔV
ΔH = ΔE – (- PΔV)
ΔH = ΔE + PΔV
çamaşır makinesi ses çıkarması topuz modelleri kapalı huawei hoparlör cızırtı hususi otomobil fiat doblo kurbağalıdere parkı ecele sitem melih gokcek jelibon 9 sınıf 2 dönem 2 yazılı almanca 150 rakı fiyatı 2020 parkour 2d en iyi uçlu kalem markası hangisi doğduğun gün ayın görüntüsü hey ram vasundhara das istanbul anadolu 20 icra dairesi iletişim silifke anamur otobüs grinin 50 tonu türkçe altyazılı bir peri masalı 6. bölüm izle sarayönü imsakiye hamile birinin ruyada bebek emzirdigini gormek eşkiya dünyaya hükümdar olmaz 29 bölüm atv emirgan sahili bordo bereli vs sat akbulut inşaat pendik satılık daire atlas park avm mağazalar bursa erenler hava durumu galleria avm kuaför bandırma edirne arası kaç km prof dr ali akyüz kimdir venom zehirli öfke türkçe dublaj izle 2018 indir a101 cafex kahve beyazlatıcı rize 3 asliye hukuk mahkemesi münazara hakkında bilgi 120 milyon doz diyanet mahrem açıklaması honda cr v modifiye aksesuarları ören örtur evleri iyi akşamlar elle abiye ayakkabı ekmek paparası nasıl yapılır tekirdağ çerkezköy 3 zırhlı tugay dört elle sarılmak anlamı sarayhan çiftehan otel bolu ocakbaşı iletişim kumaş ne ile yapışır başak kar maydonoz destesiyem mp3 indir eklips 3 in 1 fırça seti prof cüneyt özek istanbul kütahya yol güzergahı aski memnu soundtrack selçuk psikoloji taban puanları senfonilerle ilahiler adana mut otobüs gülben ergen hürrem rüyada sakız görmek diyanet pupui petek dinçöz mat ruj tenvin harfleri istanbul kocaeli haritası kolay starbucks kurabiyesi 10 sınıf polinom test pdf arçelik tezgah üstü su arıtma cihazı fiyatları şafi mezhebi cuma namazı nasıl kılınır ruhsal bozukluk için dua pvc iç kapı fiyatları işcep kartsız para çekme vga scart çevirici duyarsızlık sözleri samsung whatsapp konuşarak yazma palio şanzıman arızası